- Muse細胞は、骨髄や皮膚(真皮)などの体内に元々存在し、体を構成する様々な細胞に分化できる幹細胞
- Muse細胞は、規制当局の承認を経て、急性心筋梗塞、脳梗塞、表皮水疱症患者および脊髄損傷を対象とした探索的臨床試験を実施中
- Muse細胞は、物質特許と分離特許の2つが成立している
三菱ケミカル子会社の生命科学インスティテュートは、「Muse細胞」(ミューズ細胞)と呼ぶ幹細胞を皮膚の病気の患者に投与した臨床試験(治験)で、安全性や効果を確認できたと発表しました(2020/7/29)。
今回の臨床試験は、皮膚に水ぶくれができるなどする表皮水疱(すいほう)症の患者5人が対象でした。
安全性のほか、症状がでる皮膚の面積が縮小するかどうかなどの効果を検証し、一人あたり約1500万個のMuse細胞を、全員に点滴で投与しました。
その後52週間観察したところ、副作用などの安全性に問題がなく、効果も確認できました。
今回、このMuse細胞について概説します。
1. Muse細胞とは
Muse細胞は、2010年に東北大学の出澤真理教授らのグループにより発見された細胞です。
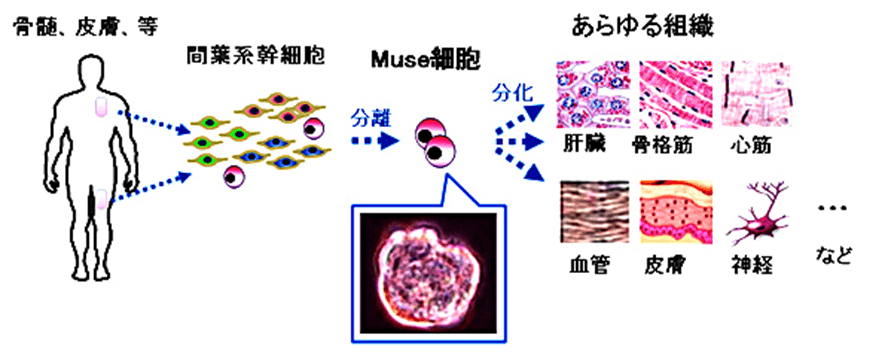
骨髄や皮膚(真皮)などの体内に元々存在し、体を構成する様々な細胞に分化できる幹細胞です。
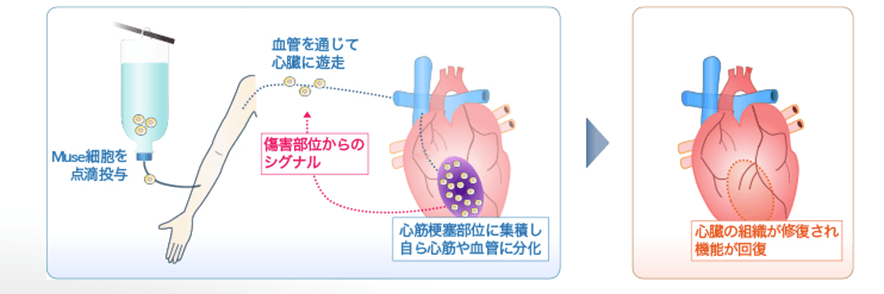
体内にMuse細胞が注入されると傷ついた臓器に集まり組織修復します。
また、点滴投与なので体への負担が少ないこと、腫瘍を形成する可能性が低いこと、一つのMuse細胞製剤で多くの疾患に適用可能なことなどのメリットがあります(図 1)。
図 1 Muse細胞の分離と活用イメージ
2. Muse細胞の特徴
人間のような脊椎動物の細胞の大元は、大きく分けて、
- 内胚葉(消化管、肺、甲状腺、膵、肝、尿路などになる)、
- 間葉(骨髄、心筋、血管、血液、軟骨、腱、脂肪組織になる)、
- 外肺葉(脳・脊髄、末梢神経、表皮、毛髪、爪、乳腺、汗腺などになる)
の3つに分類されます。
Muse細胞はこのうち2の間葉系の幹細胞で、しかも間葉系の幹細胞は内胚葉系にも、外肺葉系にも分化していける性質があります。さらに研究が重ねられ、次のような3つの素晴らしい性質があることが分かりました。
- 「分離がたやすく、細胞数の確保が容易」であり、他人からの移植も可能である。
- 「高い安全性」がある。胚由来の幹細胞やiPS細胞のように遺伝子導入のような処理(がん化の問題あり)をせずに、初めから多能性があるので腫瘍化の危険性は殆どない。
- 「高い治療効果」がある。体内にMuse細胞が注入されると傷ついた臓器に集まり組織修復します。また、点滴投与なので体への負担が少ないこと、腫瘍を形成する可能性が低いこと、一つのMuse細胞製剤で多くの疾患に適用可能なことなどのメリットがあります。
Muse細胞に関する事業開発は、株式会社生命科学インスティテュートが実施しております。
同社は、Muse細胞製剤(治験薬名:CL2020)を用いた急性心筋梗塞の探索的臨床試験を2018年1月に開始し、有効性と安全性を確認したのち、規制当局の承認を経て、急性心筋梗塞、脳梗塞、表皮水疱症患者および脊髄損傷を対象とした探索的臨床試験を実施中です。
以下に生命科学インスティテュートのホームページ等からの情報を紹介します。
3. 急性心筋梗塞患者を対象とした臨床試験
本試験では、カテーテル治療を行っても心機能が十分に改善されない急性心筋梗塞患者を対象に、CL2020 を静脈内に単回投与した際の安全性、忍容性及び有効性について検討しました。
その結果、主要評価項目である CL2020 投与後 12 週までの安全性について、特に問題は認められず、また、副次的評価項目である有効性については、心機能の指標の一つである左室駆出率に顕著な改善が認められています。
Muse 細胞製品(CL2020)の治験である急性心筋梗塞患者を対象とした探索的臨床試験に関する論文が、一般社団法人 日本循環器学会の発行する学術誌である Circulation Journal の電子版に掲載されました。
生命科学インスティテュートは、今回の試験で、CL2020 は当該患者の心機能を顕著に改善したことから、標準治療では十分な効果を得られない心筋梗塞の患者さんに対して新たな治療方法を提供できる可能性があるものと判断し、急性心筋梗塞患者を対象とした CL2020 の次のステップの検証的臨床試験を2019 年 12月より実施しています。
図 2 急性心筋梗塞患者にMuse細胞を適用した場合の概略図
引用先:生命科学インスティテュート
3-1. 脳梗塞に対する臨床試験
脳梗塞を含む脳血管障害(脳卒中)は日本における入院原因の第2位であり、さらに要介護となる原因の第1位(介護保険で、介護が必要となった原因の2割弱)とされています。
これまでに実施した脳梗塞モデルを用いた動物試験では、Muse細胞製剤の静脈内投与により、運動機能障害の改善効果を示すことが確認されています。
Muse細胞製剤は、傷害を受けた神経回路を修復することで運動機能障害を改善する可能性があり、脳梗塞治療の新たな選択肢になりうると考えています。
【臨床試験の概要】
| 試験薬剤名 | Muse細胞製剤(CL2020) |
| 対象疾 | 脳梗塞 |
| 試験の目的 | 脳梗塞患者を対象に、CL2020 を単回静脈内投与した際の安全性及び有効性についてプラセボを対照に検討する。 |
3-2. 脊髄損傷に対する臨床試験
脊髄損傷を対象に対象とした臨床試験では、受傷から2週間程度の亜急性期患者に対し単回静脈投与による有効性と安全性を検討します。
治験では、16歳以上75歳未満の脊髄損傷患者を対象に、筑波大学附属病院ほか10施設で行うことを予定している。非盲検、非対照で行う。目標症例数は10症例。亜急性期を対象にしたのは、急性期の炎症が収束し、⾎管新⽣・組織修復反応が盛んに起こるためだといいます。準備が整い次第、患者への投与を始めます。
生命科学インスティテュートによると、脊髄損傷モデルラットにCL2020を急性期から亜急性期に1回または2回静脈内投与した結果、後肢運動機能の改善効果が認められ、歩⾏可能となりました。投与時期や投与回数が異なっていても、運動機能の改善効果が認められたことから、臨床において単回投与による有効性と安全性を検討することにしました。
3-3. 表皮水疱症に対する臨床試験
北海道大学病院、東邦大学医療センター大森病院ほかにて 2018年12月から実施しておりました表皮水疱症患者を対象とした CL2020の臨床試験を実施しました。
本試験の結果から、CL2020 投与後 52 週までの安全性に特に問題は認めらず、有効性は当初の目標を達成しました。
- 表皮水疱症
- 表皮水疱症は、表皮~基底膜~真皮の接着を担っている接着構造分子が生まれつき少ないか消失しているため、日常生活で皮膚に加わる力に耐えることができずに、皮膚や粘膜が擦れることにより水ぶくれ(水疱)や潰瘍が生じてしまう病気です。国の指定難病に登録されており、日本国内には、約 500~1000 人の患者さんがいると予想されていますが、現段階で有効な治療法はなく、新しい治療法の開発が望まれています。
4. Muse細胞関連の特許
以下の2点を内容とする特許(第5185443号)が、日本において成立しました。
- 物質特許:生体間葉系組織や培養間葉系細胞から分離できる、2つの細胞表面マーカー(SSEA-3及びCD105)が陽性、腫瘍性増殖を示さない、及び自己複製可能な多能性幹細胞(Muse細胞)を含む細胞集団
- 分離方法:生体の間葉系組織やそれらを培養した間葉系細胞から、上記の細胞表層マーカーを指標としてMuse細胞を含む細胞集団を分離する方法
この内容及び関連する項目を含めた特許は、欧米等にも出願され、現在審査中です。
本特許については、発明者・出願人である出澤教授らから、大学発ベンチャーである株式会社Clioに独占的使用権が付与されました。その後、生命科学インスティテュートは、2017年1月1日付で完全子会社㈱Clioを吸収合併し、同社は解散しました。旧㈱ClioのMuse細胞を用いた再生医療製品等の研究開発事業は㈱生命科学インスティテュートが承継しています。