アメリカにおける幹細胞研究のはじまり
幹細胞研究の最初は、造血幹細胞(骨髄の中で血球をつくり出すもとになっている細胞)の移植研究(血液がんや免疫不全など病気の治療に用いられる)であると言われています。
先にも述べましたが、第二次世界大戦中(1939年~1945年)のアメリカでのマンハッタン計画が発端となっています。
マンハッタン計画とは、原子力爆弾の開発・製造に関するプロジェクトです。
その研究・開発の中で造血幹細胞の移植に関するヒントが見つけ出されたと言われています。
第二次世界大戦は終わり、1960年代はじめにジェイムズ・ティルとアーネスト・マカロックは、マウスに放射線を照射して骨髄細胞を死滅させ、再度、骨髄細胞を注射するという研究を始めました。
大量の放射線を受けたマウスは、骨髄が冒され造血幹細胞の働きが障害されて、血液をうまく作り出すことができなくなってしまいます。しかし、他のマウスの骨髄細胞を移植することで、その命を救えるということがわかってきました。
そしてこれらの研究を進める中で、「分化能」と「自己複製能」があることを証明し、「幹細胞」という概念が確立されました。
その後、1960年代後半、エドワード・ドナル・トーマスらによって白血病患者に対する骨髄移植による治療が開始され、その手法が確立されていきました。
これが幹細胞を用いた初めての臨床治療となります。
ただし、これは現在の幹細胞治療と違い、膨大の数のドナーマッチングを必要とします。そのため、ドナーバンクに適合者がいない場合、当然のように治療はできませんでした。
3つの幹細胞の分類と歴史を振り返る
幹細胞は以下のように分類されています。
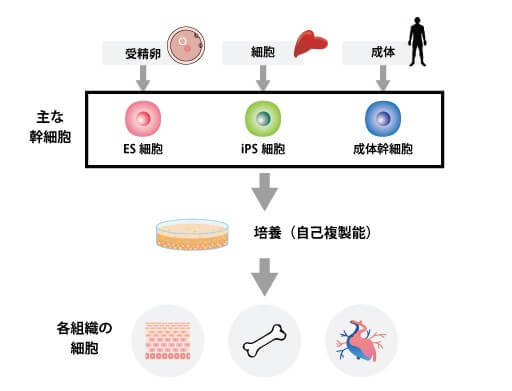
胚性幹細胞(ES細胞)
胚性幹細胞とは、「胚」からつくられる多能性幹細胞です。
受精卵から分離し、あらゆる細胞に分化できる能力(多能性)を持っている細胞で、ES 細胞と呼ばれます。
精子と卵子が受精した「受精卵」は細胞分裂を繰り返し、やがて胎児へと成長します。
この初期の段階である胚盤胞期の胚から内部細胞塊を取り出して ES 細胞は作られます。
1981 年
ES 細胞はイギリスの科学者であるマーチン・エバンスらによって開発されました。
マウスから作られた ES 細胞はシャーレの中で簡単に培養できたため、シャーレ上で遺伝子を操作し遺伝子の組み換えを行うことが可能でした。
1989 年
ある特定の遺伝子を壊して、遺伝子が欠損したマウス(ノックアウトマウス)を作ることに成功しました。
これは、既に機能が分かっている遺伝子をあえて壊すことによって、ノックアウトマウスと通常マウスを比較し、病気と遺伝子がどのように関係しているのかなどを探求しています。
1998 年
アメリカのジェームズ・トムソンらが、ヒトの胚からES 細胞を作ることに成功しました。
しかし、残念ながらES 細胞の実用化には至りませんでした。その理由として、免疫拒絶反応や倫理的問題が挙げられました。
2007 年
ノックアウトマウスの開発の成果が認められ、マーチン・エバンスと共同研究者のマリオ・カペッキ、オリバー・スミシーズはノーベル生理学・医学賞を受賞しました。
先述したとおり、ES 細胞(胚性幹細胞)は受精卵の成長段階から胚を抽出して作る多様性細胞です。
ということは、ヒトの胚を抽出せずに胎内にあり続ければ胎児となり、ヒトとなる存在です。
したがって、医療の研究のためとはいえ、そこに手を加えて壊したり、操作したりする行為は許されるものではない、という反対意見があります。そのため、現在でも倫理規定やガイドラインなどが設けられ慎重な対応が求められています。
人工多能性幹細胞(iPS 細胞)
受精後間もない細胞(全能性幹細胞や多様性幹細胞)は、あらゆる細胞に分化できる能力をもっています。
しかし、成長したヒトの皮膚の細胞は、細胞分裂をしても皮膚の細胞にしかなれません。
多様性の能力を残したままシャーレの中で培養することを可能にしたのが ES 細胞ですが、多様性を持たない皮膚の細胞などから、ES 細胞と似た性質(多様性)の細胞を人工的に作り出したものが iPS 細胞です。
◆ 2006 年
京都大学の山中伸弥教授(当時)が、ES 細胞のようにあらゆる細胞に分化できると能力を持った細胞を作り出すことに成功しました。
この細胞が iPS 細胞と名付けられました。iPS 細胞は患者自身の皮膚の細胞から作り出すことができるので、ES 細胞が抱える拒絶反応や倫理的問題を解決できる可能性があります。
◆ 2012 年
iPS 細胞の開発において山中教授にノーベル医学・生理学賞が授与されました。
◆ 2014 年
世界で初めて iPS 細胞からつくった網膜色素上皮細胞の移植手術を実施。
11 月に厚生労働省により「再生医療等の安全性の確保等に関する法律」が施行されます。これにより日本でも多くの臨床や治療が行われるようになりました。
◆ 2022 年
慶応大学グループが、世界で初めて脊髄損傷の治療に iPS 由来の細胞を移植しました。
日本政府は 2019 年、iPS 細胞の研究支援資金の打ち切りを発表
これにはさまざまな理由があると言われていますが、1つ大きな問題がありました。
それは、iPS 細胞を作成時に発癌に関連する遺伝子を用いているため、細胞が癌化してしまうリスクがあるということです。
このことは当初より指摘されていたそうですが、研究過程において解決できると考えられていたようです。
しかし、癌化リスクの解消は現在においても未完であり、実用化までには相当な年月がかかると言われています。
体性幹細胞(成体幹細胞)
体性幹細胞は、成体幹細胞とも言われています。
ES 細胞や iPS 細胞のようにどんな細胞にでもなりうる能力を持ち合わせてはいません。分化する能力は持っていますが、分化できる細胞の種類が限定されています。
例えば、血液系の細胞を作る「造血幹細胞」、神経系の細胞を作る「神経幹細胞」といったように、その役割が限られていると考えられていました。
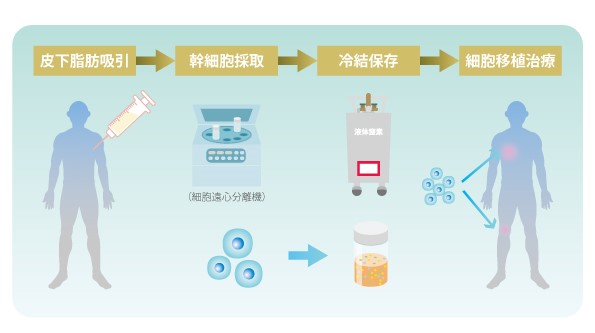
しかし、体性幹細胞の中でも「間葉系細胞」はさまざまな器官や組織に分化できる細胞であり、皮膚や脂肪、骨髄などあらゆる場所に存在していることがわかりました。
ES 細胞や iPS 細胞に比べると、分化できる細胞は限られますが、培養には自分自身の細胞を用いることができ、採取も容易であるため、すでに実際の治療に用いられているものもあります。
現在行われている幹細胞を活用した研究
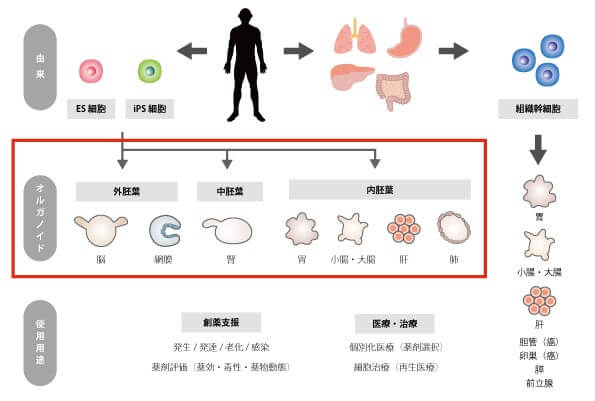
最近では、世界でも「オルガノイド」の研究が急速に進んでいます。
オルガノイドとは、本来は体の中にあって観察できない器官や組織を、体の外(試験管)で観察できるように、人工的に作られた小さな臓器です。
オルガノイドは幹細胞や前駆細胞から作製されるもので、専用の成分等と混合すると、臓器と同じ機能を持つ小さな臓器を作ることができるのです。
日本でも、脳や肝臓、腎臓などさまざまな臓器のオルガノイド作製法が開発されており、病気の解明や再生医療の開発が進んでいます。
美容分野で注目される幹細胞というキーワード
美容分野では幹細胞という言葉が注目されていますが、実際に幹細胞自体を化粧品に配合することは不可能です。
なぜならば幹細胞は非常にデリケートな生体であり、CPC(細胞培養加工施設)から出してしまうと数時間で死んでしまうからです。
幹細胞を生かすためには、厳格な温度管理と高濃度酸素+アルブミン(幹細胞のための栄養素)が必要です。
その環境下でも細胞の生存は 48 時間が限界で、それ以上の保存となるとマイナス 196℃以下(液体窒素)での保存が必須となります。
さらにもう一つ、化粧品に配合することができない理由としては、幹細胞の培養には 1 回、1 人分の量で数百万から数千万円の培養コストがかかるということがあります。
このように物理的、またはコスト的に化粧品原材料として用いることは不可能なのです。
では、幹細胞を培養するときに使われる培養液から抽出された、培養上清液はどうでしょうか?
培養上清液も細胞ほどではないにせよ、非常にデリケートで高価な物です。具体的には 1 年以上の保存にはマイナス 80℃の冷凍庫が必要です。
それが不可能な場合は、相当のコストをかけてフリーズドライにし、パウダー化するしかありません。
価格においても、実際の医療現場では1cc あたり約 1 万円で売買されおり非常に高価です。
このような状況から、化粧品原材料で用いることは可能ではありますが、一般の方が考えるような液体での常温保存は不可能であり、また、非常に高価な製品となってしまいます。
現状では、当機構の調査においては、確かに(失活せず)幹細胞上清液が入っていると思われる製品は数社のみと認識しています。
99%の製品は名ばかりですが、正しい保存方法と配合方法で、より多くの幹細胞関連の製品が世に出ることを期待したいものです。
幹細胞研究の未来
幹細胞の歴史を振り返ると、その可能性に古くから注目していた研究者の方々がたくさんいたことがわかります。
しかし幹細胞は、一部を除いて、ほとんどが研究段階であり、まだまだ実用化には至っていません。
ES 細胞や iPS 細胞においては、たくさんの可能性を秘めてはいますが、実際の治療として取り入れられるようになるには、さらなる研究が必要なのです。
一方で MSC(間葉系幹細胞)においては、近年、アメリカを中心として多くの製薬会社、バイオベンチャー企業が多額の資本を得て数百の難治性疾患に対し治験を行っています。
実際に行っている治験の正確な数も発表され、その多くがフェーズⅡ(比較的軽度な少数例の患者を対象に、安全性が確認された用量の範囲内で、治験薬の安全性と有効性等を調査)からフェーズⅢ(数百から数万という患者を対象に、治験薬を投与して詳細な情報を収集し、有効性を調査)に差し掛かろうとしています。
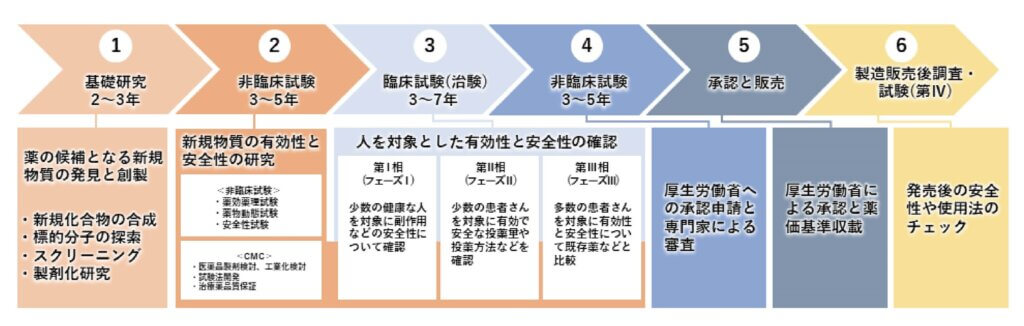
このままのペースで研究や治験が進めば、5 年から 10年後には FDA(アメリカ食品医薬品局(Food and Drug Administration)の略称)や厚生労働省の許可のもと、承認薬として治療に使われることでしょう。
これまで治療が不可能だったさまざまな病気が幹細胞を中心とする細胞医薬品により治る未来がすぐそこまで来ています。
「はじめに」でも述べましたが、市場の拡大はもはや疑いようはなく、2050 年には年間 60 兆円の市場規模が見込まれているようです。
価格が非常に高額になることが予想されたりと、まだまだ諸々の課題は残りますが、医療の概念が覆されるのもそう遠くないと思われます。
当機構の役割とは?
当機構は、『様々な病気やケガ、体の悩みなどを抱えているにも関わらず、これまでの医療では解決できなくて苦しんでいる』という方々に、幹細胞の力によってその問題を解消するだけでなく、より豊かな人生を歩んでほしいという願いを持っております。
幹細胞は人類の未来への大きな希望ですので、今後一人でも多くの人に幹細胞の情報を知っていただき、活用していただきたいと思っています。
当機構は、そのために当サイトを通して、できる限り多くの情報を提供していきます。
また、今、目の前の問題を抱えている方からご相談をいただいた際には、少しでもお力になれるよう、個別でその方に応じた情報を提供をさせていただきます。
当機構の詳しい役割や、幹細胞に関する最重要事項はこちらの記事で解説しています。
是非一度ごらんください。

