重い心臓病を対象としたiPS心筋細胞を使う臨床研究
人工多能性幹細胞(iPS細胞)から作った心筋細胞を重い心臓病の患者に移植する2つの臨床研究が進んでいます。
一つは大阪大のiPS細胞由来の心筋細胞シートを使う研究で、もう一つは慶応大のiPS細胞由来の再生心筋細胞の心筋球を使う研究です。以下に2つの臨床研究の概略を紹介します。
阪大の臨床研究(心筋細胞シート)
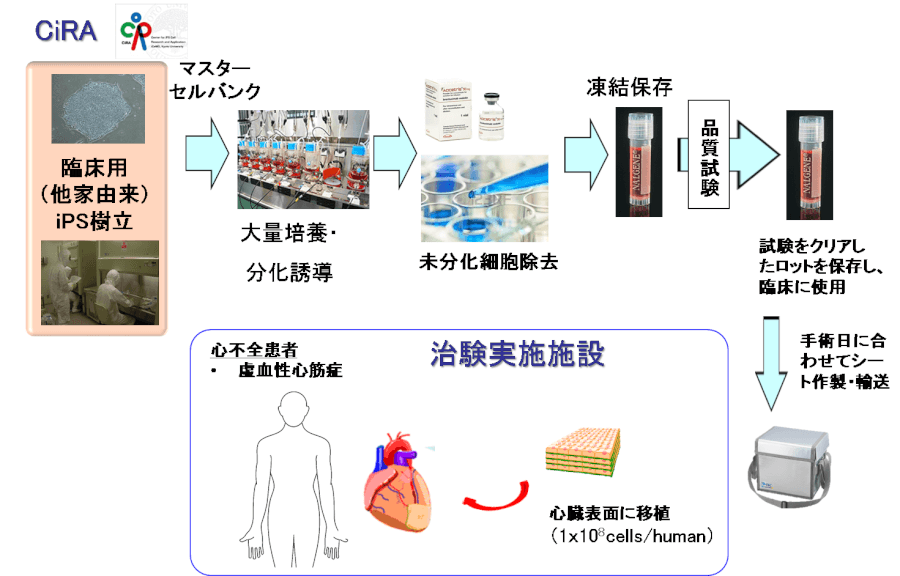
阪大の臨床研究のiPS細胞から移植までの流れを図1に示します。
まず、京都大学が蓄積するiPS細胞を培養して増やし、心臓の細胞を作る。次に腫瘍化のリスクのある未分化細胞を除去した上で凍結保存しておき、手術日程に合わせて解凍して培養し、シート状に加工する。手術では心筋梗塞などで傷んだ心臓の患部にシートを数カ所に貼り付けます。1年間の経過観察で、安全性や心機能の回復度合いなどの有効性を調べる。
成功すれば、心臓移植や人工心臓装着以外に有効な治療法がない重症心不全の患者さんを対象とし、心機能の改善や心不全状態からの回復等の治療効果が期待されます。
図 1 iPS細胞から移植までの流れ(大阪大学)
引用先:http://www.med.osaka-u.ac.jp/archives/20776)
大阪大は2020年1月27日、iPS細胞(人工多能性幹細胞)から作ったシート状の心臓の筋肉細胞(心筋シート)を重症心不全患者(1例目)に移植し、経過は順調と発表しました。
最終的に計10人に移植して安全性と有効性を確認する。5年以内の実用化を目指しています。
慶応大の臨床研究(心筋球)
慶應義塾大学のグループが計画中の「難治性重症心不全患者を対象とした同種iPS細胞由来再生心筋球移植の安全性試験」の実施が厚生労働省によって認められたことを、実施責任者である同大学医学部内科学(循環器)教室教授の福田恵一氏が発表しました(2020年8月)。
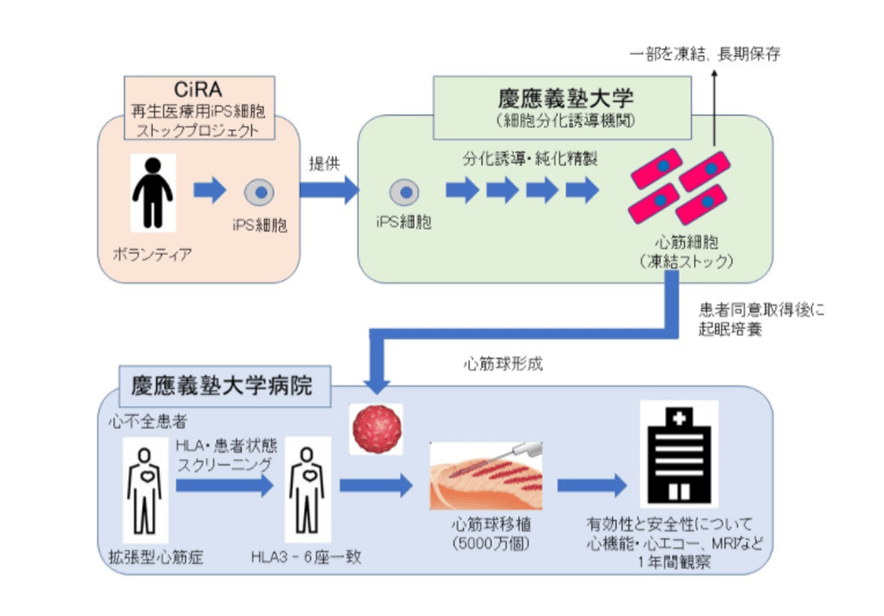
この慶応大の臨床研究のiPS細胞から移植までの流れを図2に示します。
この臨床研究は「拡張型心筋症」という重い心臓病の患者が対象です。心臓の壁が薄くなり血液を押し出す力が弱まる病気で、福田教授によると国内に2万5千人の患者がいます。
京都大学iPS細胞研究所が健康な人の細胞から作ったiPS細胞を心筋の細胞に育てたうえ、特殊な注射針状の器具で患者の心筋内に移植します。対象となる患者は3人の予定です。研究グループによると、心筋の内部に移植した細胞は血中の免疫細胞に触れる機会が少なく、拒絶反応が起こりにくいとみられます。
さらに、移植する細胞と患者の免疫の型「HLA」を一致させて免疫反応を抑え、長期にわたって治療効果が期待できるといいます。1年間かけて経過を観察し、移植した細胞や移植方法の安全性を確かめます。なお、HLA抗原は白血球の表面にある目印で、ヒトが自己と非自己を認識する上でもっとも重要な抗原です。
図 2 iPS細胞から移植までの流れ(慶応大学)
引用先:https://www.amed.go.jp/news/release_20200206-03.html
対象となる心疾患の治療の現状
2つの臨床研究はいずれも重症心不全となった患者さんが対象ですが、心不全の原因疾患は大阪大学の研究では虚血性心筋症、慶応大学では拡張型心筋症です。以下に疾患ごとに現状を説明します。
虚血性心筋症(大阪大学)
狭心症、心筋梗塞を合併し、心臓への血のめぐりが悪いのが原因で心臓全体の収縮力が落ちて左室壁が拡大し、心機能が悪化する病気です。欧米では非常に多くの方がかかる病気ですが、日本でも増加傾向にあります。
冠動脈に病変がある場合は、カテーテル治療、冠動脈バイパス術などで原因治療を行います。心筋症に対しては、内科的に心臓に負担をかけない治療が主となります。しかし限界の場合は心臓移植、左室形成手術となりますが、移植は現実的に不可能で、左室形成手術の効果にも限界があります。僧帽弁閉鎖不全症を合併することが多く、さらに心臓に負担をかけ状態が悪化することがあります。その場合は人工弁置換術あるいは弁形成術という僧帽弁の手術をして少しでも弱った心臓の負担をとることもあります。心臓そのものが改善させるわけではありませんが症状の改善が見込まれます。
また、心室性不整脈がひどい場合、心機能の悪化が心室の刺激の不良によるもの(脚ブロック)であれば、植え込み型除細動器移植術、両心室ペースメーカー移植術、さらには植込み型補助人工心臓、心臓移植の適応になることがあります。
重症の場合、心不全、不整脈で突然死を起こす危険性があります。程度が軽い場合はそのまま心不全症状が出現せずに経過する場合もあります。
拡張型心筋症(慶応大学)
拡張型心筋症は進行性に心筋収縮能が低下し、左心室の拡大を起こして、心不全症状をきたす心筋疾患のひとつです。診断は特定心筋症(虚血性、弁膜症性、高血圧性、サルコイドーシスなど全身性疾患に伴うものなど)を除外することによって確定します。
かつては原因不明とされていましたが、近年では1. 家族性(遺伝の影響による)、2.心筋炎、3.自己免疫(免疫系が間違って自分を攻撃してしまう)による原因が考えられています。
家族性は、心筋細胞を構成する蛋白質の遺伝子変異により発病し、全体の約2割程度を占めるとされています。心筋炎では主にウイルス感染を契機に、免疫異常を引き起こして心筋細胞の障害にいたります。急性心筋炎が治る過程で異常が起こるタイプ、あるいは自覚症状のない間に慢性的に心筋炎を起こす慢性心筋炎のタイプがあります。
また、自己免疫によって心筋の蛋白質に対して様々な自己抗体があらわれ、心筋障害を引き起こすことが報告されており、拡張型心筋症の患者さんの8割以上にこれらの自己抗体を認めています。
治療目標は、1.症状の改善、2.不整脈のリスク管理を行うことによって、心不全による入院を減らし、生活の質を向上させ、寿命の延長を目指します。基本は薬物治療ですが、必要に応じて、非薬物治療(酸素療法、心室再同期療法)を組み合わせて行います。
最大限の内科治療を行っても改善できない重症心不全患者では、心臓移植の適応となります。日本では心臓移植は移植までの待機時間が海外に比べて非常に長いため(平均3年以上)、補助人工心臓治療により移植までの時間をかせぐこともあります。
iPS心筋細胞の臨床応用に関する今後について
心筋シートを用いた心外膜側への移植と心筋内への直接注射は、それぞれ一長一短があるようです。最適な移植方法はまだ確立されていません。体性幹細胞の利用を含め、今後新たな移植方法の開発も含めた最適化が必要です。
実用化に向けた問題はいくつかあります。まず挙げられるのは、iPS細胞の作製は、染色体に遺伝子を取り込ませる方法や発がんに関連する遺伝子を使っていることから、利用後のがん発症のリスクがまだ十分に解明されていないということです。
次に挙げられるのは、細胞を安全に分化させるための標準方法が確立されていないことです。
iPS細胞から新しい細胞を作ることができれば、すぐに治療につなげられると考えられがちですが、細胞という小単位のみで治療できる病気は限られています。
そこで、次の段階としてはより機能が発揮できるように、組織や臓器の複製や作製へと望まれるところですが、これらを達成するために超えなければならない技術的ハードルは、非常に高いと想像できます。